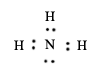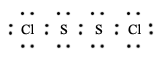| 1. |
a) Ett ämne övergår från gas till vätska
b) Ett ämne övergår från gas till fast ämne
eller tvärtom
|
| 2. |
Använd formeln A = Z + N där A = 23 och Z = 11 viket ger N = 12
vilket är svaret
|
| 3. |
a) K=2, L=8, M=2
b) K=2, L=8, M=13, N=2
|
| 4. |
Placeringen i grupp 16 och placeringen mellan S och Te respektive
As och Br ger följande:
Se har 6 valenselektroner, är en icke metall, bildar tvåvärt negativa
joner, smältpunkt mellan S och Te, atom- och jonstorlek mellan As och
Br, bildar föreningarna H2Se, H2SeO3,
H2SeO4 och SeO2
|
| 5. |
a) Fe2(SO4)3
b) Ba5N2
|
| 6. |
4 och 6
|
| 7. |
| a) |
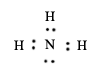 |
b) |
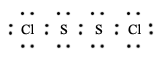 |
|
| 8. |
Tre av följande fyra varianter skall anges
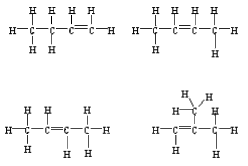
|
| 9. |
| C17H35COOH + 26 O2 |
 |
18 CO2 + 18 H2O |
|
| 10. |
Svar: 7,3 g. Använd
formlerna n=V · c och m=n · M.
|
| 11. |
| a) |
2··27,0+3··(32,1+4··16)=342,3
g/mol |
| Svar: 0,1489 M Al2(SO4)3-lösning |
| b) |
[Al3+] = 0,2978 M (2·0,1489) |
|
| 12. |
Svar: 87,1 %. Enligt formeln svarar 3 mol H2 mot 2 mol
Al. Dvs 1 mol H2 mot 2/3 mol Al. Använd allmänna
gaslagen för att beräkna antal mol H2 (0,01692
mol). Detta ger 0,01128 mol Al som väger 0,3047 g. Av detta kan
%-halten beräknas (0,3047/0,350)
|
| 13. |
| H2CO3 + H2O |
 |
H3O+ + HCO3- |
| HCO3- + H2O |
 |
H3O+ + CO32- |
|
| 14. |
c, b, a
|
| 15. |
5,0
|
| 16. |
a och c
|
| 17. |
| a) |
| HNO3(aq) + NaOH(aq) |
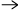 |
NaNO3(aq) + H2O |
|
| b) |
Vid ekvivalenspunkten är antal mol bas = antal mol syra
V · 0,100 = 0,025 · 0,15
V = 0,0375 |
| Svar: 37,5 cm3 NaOH går åt |
|
| 18. |
a) Fe(III)
b) Ag+
|
| 19. |
| S2- + 4I2 + 8OH- |
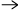 |
SO42- + 8I- + 4H2O |
|
| 20. |
b och e I dessa båda fall är eo för oxidationsmedlet
> än eo för reduktionsmedlet
|
| 21. |
| anodreaktion: |
2H2O |
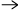 |
O2 + 4H+ + 4e-- |
| katodreaktion: |
2H2O + 2e- |
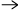 |
H2 + 2OH- |
Aluminiumjonerna och sulfatjonerna deltar inte i elektrolysen på
annat sätt än att transportera strömmen i lösningen.
|
| 22. |
a) alternativ 2 felaktigt
b) bult av koppar, plåt av järn t ex |