| 2.1 |
| Använd formeln A = Z + N och |
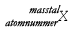 |
| a) A = 16 |
Z = 8 |
|
 |
N = A - Z = 16 - 8 = 8 |
| b) A = 17 |
Z = 8 |
|
 |
N = 17 - 8 = 9 |
| c) A = 18 |
Z = 8 |
|
 |
N = 18 - 8 = 10 |
| d) A = 20 |
Z = 10 |
|
 |
N 20 - 10 = 10 |
| e) A = 22 |
Z =10 |
|
 |
N = 22 - 10 = 12 |
| f) A = 238 |
Z = 92 |
|
 |
N = 238 - 92 = 146 |
se även http://www.liber.se/mnt/kemi/Index/ |
2.2-
2.5 |
Se svar och anvisningar till läroboken.
|
| 2.6 |
| Ar |
A=40 |
Z=18 |
N = 40 - 18 = 22 |
| K |
A=40 |
Z=19 |
N = 40 - 19 = 21 |
| Ca |
A=40 |
Z=20 |
N = 40 - 20= 20 |
|
| 2.7 |
Se svar och anvisningar till läroboken.
|
| 2.8 |
Se http://www.liber.se/mnt/kemi/Index/ |
| 2.9 |
Se svar och anvisningar till läroboken.
|
| 2.10 |
- antal protoner avgör vilket grundämnet är, därför
har alla kloratomer, oavsett masstal och laddning,
samma kärnladdning.
- Relationen mellan atomkärnans storlek och atomens är
följande: om du tänker dig atomkärnan stor som
en apelsin, så kommer elektronerna befinna sig ungefär
en km från kärnan. Elektronens storlek i denna jämförelse
är ungefär som en fotboll.
- Kärnan består ju av protoner och neutroner. Dessa
har ungefär samma massa. Elektronerna, som ju utgör
atomens yttre kontur, har en massa som är ungefär 0,25
% av kärnans massa.
- Detta påstående är felaktigt. Se svaret på
a) uppgiften.
- För de två klorisotoper som omnämns här
gäller att
| A = 35 |
|
Z = 17 |
|
N = 35 - 17 = 18 |
| A = 37 |
|
Z = 17 |
|
N = 37 - 17 = 20 |
- Antal elektroner = antal protoner dvs 17 för alla kloratomer
|
| 2.11 |
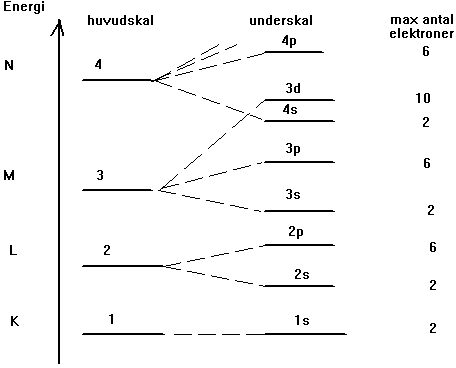
Ovan visas energidiagrammet för en atom. Elektronerna fördelar
sig i olika skal benämnda K, L, M, N osv eller 1, 2, 3 , 4 osv.
Dessa skal består vid noggrannare undersökning av olika
underskal benämnda s, p, d. Hur dessa underskal existerar i atomen
och hur de benämns framgår av figuren ovan.
Då elektronerna skall placeras ut kring en atom, fylls dessa
på nerifrån. Detta för att atomen skall få
så låg energi som möjligt.
- klor har atomnummer 17 och därmed 17 elektroner. Dessa placeras
på följande sätt: K skalet 2 st, L skalet 8 st (2+6), M skalet
7 st ( 2+5)
- Kobolt har atomnummer 27 och därmed 27 elektroner. Fyll
på nerifrån: K-skalet 2 st, L-skalet 8 st (2+6), M-skalet
15 st (2+6+7), N-skalet 2 st. M-skalet är inte fullt. Underskalet
4s fylls på med två elektroner innan underskalet 3d
fylls på varför antalet elektroner i detta skal bara
blir 7 st.
|
| 2.12 |
Från gruppens nummer i periodiska systemet kan du få
fram antalet valenselektroner.
| a) |
natrium tillhör grupp 1 |
 |
1 valenselektron |
| b) |
klor tillhör grupp 17 |
 |
7 valenselektroner |
| c) |
magnesium tillhör grupp 2 |
 |
2 valenselektron |
| d) |
syre tillhör grupp 16 |
 |
6 valenselektron |
|
