Kapitel 5
Lösningarna kan också skrivas ut HÄR| 5.1 | Kommentar till facit. Vid beräkning av formelmassor och molmassor
brukar man inte använda sig av mer en decimal på atommassorna.
Detta på grund av de kemikalier man har aldrig är 100%
rena. Läroboken följer dock inte denna konvention varför
vissa mindre skillnader kan finnas i facit till läroboken och
lösningarna i detta häfte. |
||||||||||||||||||||||||||||||||||||
| 5.2 | Formelmassan är summan av de i en formelenhet
ingående atomernas massa uttryckt i enheten u. Atommassorna
finner du i en atomviktstabell eller i periodiska systemet.
|
||||||||||||||||||||||||||||||||||||
| 5.3 | C2H6 består av
Massprocenten väte blir då 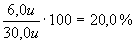 |
||||||||||||||||||||||||||||||||||||
| 5.6 |
|
||||||||||||||||||||||||||||||||||||
| 5.8 | Jämför lösningarna till uppgifterna 5.6 och 5.2. Som du ser blir mätetalen de samma när man beräknar formelmassor och molmassor, men enheten ändras från u till g/mol. | ||||||||||||||||||||||||||||||||||||
| 5.9 | Se http://www.liber.se/mnt/kemi/Index/ |
||||||||||||||||||||||||||||||||||||
| 5.13 | Använd formeln n= m/M som kan skrivas om till m=n·M
|
||||||||||||||||||||||||||||||||||||
| 5.14 | Använd formeln n = m/M där n= substansmängden (antal
mol), m=antal g och M=molmassan. m = 10 g M = 342 g/mol Svar: Substansmängden var 0,029 mol Svaret skall ges med lika många värdesiffror som den minst noggrant givna uppgiften. |
||||||||||||||||||||||||||||||||||||
| 5.15 | Använd formeln n = m/M
Se även http://www.liber.se/mnt/kemi/Index/ |
||||||||||||||||||||||||||||||||||||
| 5.17 | I båda uppgifterna gäller att antal mol silver = antal
mol magnesium respektive antal mol guld eftersom de skulle innehålla
lika många atomer.
|
||||||||||||||||||||||||||||||||||||
| 5.18 | Antag att föreningens empiriska formel är PbxOy Antal gram svavel i föreningen måste vara skillnaden mellan kopparsulfidens massa och kopparbiten massa dvs 0,824 g - 0,659 g = 0,165 g. Bilda kvoten mellan antal Cu-atomer / antal S-atomer = antal mol Cu / antal mol S Det är lättast att lösa problemet om man väljer att sätta det man har minst av i nämnaren. Svar: empiriska formeln är Cu2S |
||||||||||||||||||||||||||||||||||||
| 5.20 | Antag att föreningens empiriska formel är CrxOy Betrakta exempelvis 100 g av denna förening. Denna mängd innehåller 68,5 g krom. Återstoden måste vara syre dvs 31,5 g. Bilda kvoten mellan antal O-atomer / antal Cr-atomer = antal mol O / antal mol Cr. Det är lättast att lösa problemet om man väljer att sätta det man har minst av i nämnaren. Det går alltså tre stycken syre på två stycken kromatomer Svar: Empiriska formeln är Cr2O3. |
||||||||||||||||||||||||||||||||||||
| 5.21 | Antag att föreningens empiriska formel är PbxOy Betrakta exempelvis 100 g av denna förening. Denna mängd innehåller 90,7 g bly och 9,3 g syre. Bilda kvoten mellan antal O-atomer / antal Pb-atomer = antal mol O / antal mol Pb. Det är lättast att lösa problemet om man väljer att sätta det man har minst av i nämnaren. Det går alltså fyra stycken syre på tre stycken blyatomer Svar: Empiriska formeln är Pb3O4 |
||||||||||||||||||||||||||||||||||||
| 5.22 | Antag att empiriska formeln är CxHy Betrakta 100 g av ämnet. Denna mängd innehåller: Empiriska formeln är således C2H5,, vilket anger det enklast förhållandet mellan atomerna i föreningen. Den sökta molekylen är en multipel av denna. En förening med sammansättning C2H5 har molmassan 2·12 + 5·1= 29 g/mol medan den sökta föreningen har molmassan 58 g/mol dvs dubbel så stor. Molekylformel blir således C4H10. Svar: Den sökta molekylformeln är C4H10 Se även http://www.liber.se/mnt/kemi/Index/ |
||||||||||||||||||||||||||||||||||||
2004 Nationellt centrum för flexibelt lärande