Studiearbeten 3
Studiearbete
3 för utskriftKom ihåg att ange lärarens namn på kuvertet och Ditt namn på lösningarna
Några av uppgifterna är försedda med asterisk (*) efter numreringen. Det betyder att dessa uppgifter är frivilliga och eventuellt lite svårare (av VG – MVG- karaktär).
- Skriv protolysformeln i vatten för:
a) den svaga syran kolsyra H2CO3. Tänk på att kolsyra kan protolyseras i två steg. Skriv protolysformel för båda protolysstegen.
b) karbonatjonen CO3 2- som är en svag bas.
- a) Beräkna pH-värdet i en flaska som innehåller 0,02 mol/dm3
saltsyra. (Temperaturen antas vara +25 °C)
b) Man späder lösningen i a 100 ggr. Vilket pH får lösningen då?
c) ) Beräkna pH-värdet i en flaska som innehåller 0,002 mol/dm3 svavelsyra (antas vara fullständigt protolyserad i två steg).
- Under en längre tid har man med oro noterat hur pH-värdet i en sjö
har sjunkit från pH=6,0 till pH=5,0.
a) På vad sätt har vätejonkoncentrationen ändrats i sjön under den här tiden?
b) Vilken typ av ämnen ska tillsättas till sjön för att återställa pH-värdet till det ursprungliga. Motivera ditt svar.
c) Vissa sjöar har hög koncentration av HCO3--joner. Förklara varför dessa sjöar klarar sig bättre mot försurning än de med lägre HCO3--koncentration.
*d) För att inte skadorna ska bli alltför påtagliga bestämmer man sig för att göra en kortsiktig insats och planerar att kalka sjön (se a) med släckt kalk, Ca(OH)2 (s). Hur många kilo släckt kalk behöver man tillsätta för att sjön som har en totalvolym på 3000 000 m3 ska få ett pH-värde på 5,5 istället för det uppmätta 5,0.
- Vilka av följande reaktioner är endoterma? Motivera dina
svar:
a) Fe3O4 + CO 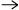
3FeO + CO2 ΔH = 38 kJ b) 2H2O2 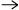
2H2O + O2 ΔH = -197 kJ c) 285 kJ + 3O2 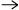
2O3 d) Mg + Cl2 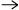
MgCl2 + 641 kJ e) N2 + 2O2 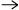
2NO2 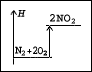
f) H2 + Cl2 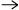
2HCl 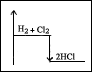
- Sätt ut oxidationstalen för de olika atomslagen i
Mn2O7 PbO H2S Cl2 PbO2 NaH
- Koppar reagerar med varm utspädd salpetersyra i överskott.
a) balansera formeln
Cu + NO3- + H+ 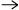
Cu2+ + NO + H2O
b) Beräkna hur många mol kväveoxid det bildas då 0,25 mol koppar reagerar.
- Du har fått i uppgift att montera ett koppartak. Vilket material
bör du välja på spiken som du fäster takplåtarna med? Motivera ditt
svar.
- *Ammoniak bildas ur elementen enligt N2(g) + 3H2(g)
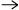 2NH3(g)
2NH3(g)
För att bestämma DH för reaktionen fördes 2,8 gram kvävgas och överskott av vätgas ner i en kalorimeter innehållande 500 g vatten. Kväve och väte reagerade och temperatur ökade med 4,402 °C. Vattnets specifika värmekapacitet är 4,18 J/g K.
a) Beräkna ΔH för bildningen av 1 mol ammoniak.
b) Beräkna ΔS för bildning av 1 mol ammoniak vid 25 °C och 101,3 kPa ur tabellen nedan.
c) Är reaktionen spontan vid 25 °C? Är den spontan vid 300 °C? Förutsätt att ΔH och ΔS är konstanta, oberoende av temperaturen.
Tabell : Entropier för olika ämnen i J/(K·mol) vid 25 °C och 101,3kPa
C (diamant) 2,4 
H2 131 C (grafit) 4,7 O2 205 Ag 43 N2 192 Ca 42 H2O 70 CaO 40 CO2 214 Ag2O 122 NH3 193
- Redovisa hemlaborationerna 4 och 5 enligt instruktionerna till varje laboration.
Lycka till!
2004 Nationellt centrum för flexibelt lärande