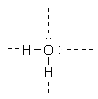Kapitel 11
Lösningarna kan också skrivas ut HÄR| 11.1 | I 4 st vätebindningar kan H2O molekylen delta se fig.
|
||||||||||||||||||||||||||
| 11.2 |
|
||||||||||||||||||||||||||
| 11.3 |
Svar: 0,96 g vattenfri kopparsulfat bildas |
||||||||||||||||||||||||||
| 11.4 | Det som återstår efter upphettningen är MgSO4.
Molmassan för MgSO4 är: 24,3 + 32,1 + 4·16,0 = 120,4 g/mol. 0,71 g MgSO4 utgör 0,71/120,4 mol = 0,00589 mol. Vattnets massa i kristalliserad magnesiumsulfat är 1,45 – 0,71 = 0,74 g. Vattens molmassa är 18 g/mol. 0,74 g vatten utgör 0,74/18,0 = 0,04111 mol.
Svar: x i formeln är 7 Se även http://www.liber.se/mnt/kemi/Index/ |
||||||||||||||||||||||||||
| 11.5 | Kaliumklorid, som är en jonförening, är löslig
i polära lösningsmedel. Både heptan och toluen är
kolväten, som är ickepolära lösningsmedel, kan
inte lösa kaliumklorid och andra salter. Metanol innehåller
en polär grupp nämligen OH-gruppen, och i detta ämnen
kan kaliumklorid lösas. Se även http://www.liber.se/mnt/kemi/Index/ |
||||||||||||||||||||||||||
| 11.6 | Se lärobokens svar och anvisningar |
||||||||||||||||||||||||||
| 11.7 | Se lärobokens svar och anvisningar | ||||||||||||||||||||||||||
| 11.8 | a) och c) är jonföreningar och är därför lösliga i vatten. d) och f) innehåller flera polära grupper och bör således vara lösliga i vatten (jämför laborationen alkoholers löslighet). Kloroform är endast svagt polär medan bensen, C6H6, är ickepolär och ingen av dessa är lösliga i vatten. | ||||||||||||||||||||||||||
| 11.10 | Se http://www.liber.se/mnt/kemi/Index/ |
2004 Nationellt centrum för flexibelt lärande