Elektronformel-strukturformel
Som nämnts tidigare strävar valenselektronerna att gruppera sig i fyra par.
Ett enkelt sätt att åskådliggöra en atom med sina valenselektroner är följande
som här visas för elementen i period 2. 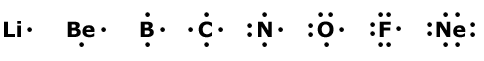 |
Detta sätt att skriva kallas elektronformel. Många gånger ersätter man två punkter, ett elektronpar, med ett streck.
En elektronparbindning består av två elektroner och brukar ritas som ett streck. Med användande av elektronformler kan molekylerna F2, H2O och CH4 ritas på följande sätt:
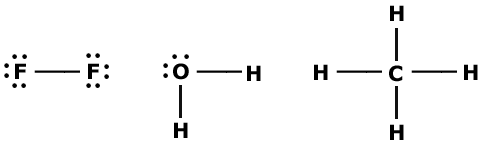 |
Denna typ av formler kallas strukturformler. Ofta utelämnar man de fria elektronparen då man ritar strukturformeln.
De fyra elektronparen kring en atom har ju alla samma negativa laddning och vill komma så långt ifrån varandra som möjligt. Därför arrangerar sig de mer eller mindre kompletta elektronparen enligt figuren nedan. Den består av fyra områden inom vilken elektronerna befinner sig. Ett sådant område kallas för orbital. Varje orbital rymmer högst två elektroner. I skärningspunkten mellan orbitalerna finns atomkärnan.
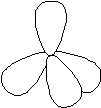 |
Om figuren föreställer en kolatom finns det en elektron i varje orbital. En stabil molekyl kan erhållas om det finns tillgång till två elektroner i varje orbital. Om fyra stycken väteatomer kopplas till var och en av orbitalerna uppnås detta. Vi har fått en metanmolekyl, CH4. Molekylens utseende framgår av figuren nedan. Jämför med strukturformeln.
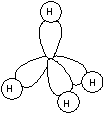 |
Föreställer figuren istället en syreatom finns redan två elektroner i två av orbitalerna medan två orbitaler endast har en elektron var. Genom att koppla på två stycken väteatomer kommer även dessa orbitaler bli kompletta.
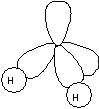 |
Detta är en vattenmolekyl och som du ser sitter väteatomerna och syreatomerna inte på en rät linje utan bildar en vinkel på 105°.
2004 Nationellt centrum för flexibelt lärande