Studiearbeten 1
Studiearbete
1 för utskriftNågra av uppgifterna är försedda med asterisk (*). Det betyder att dessa uppgifter är frivilliga och eventuellt lite svårare (av VG – MVG- karaktär).
Kom ihåg att ange lärarens namn på kuvertet och Ditt namn på lösningarna
- Som Du känner till kan materian ha tre olika aggregationsformer. Det
är viktigt inom kemin att man talar om vilket aggregationstillstånd
ett ämne har. Därför har man skaffat sig beteckningar för aggregationsformerna.
Om ett ämne är fast anges det med (s), flytande med (l) och gasformigt
med (g). Sålunda betyder H2O(s) is och H2O(g)
vattenånga. Som Du kanske vet är kemiska formeln för vatten H2O.
a)Vad kallas följande ändring i aggregationsformer?
H2O(g) 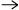
H2O(l) ?
b) Vilken sorts bindning bildas vid aggregationsformsförändringen och var uppstår bindningen?
- Hur många protoner, neutroner samt elektroner har nedanstående
atom?
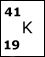
a) I vilka skal är elektronerna placerade?
b) Hur många valenselektroner har denna atom?
c) Rita atomens elektronformel.
- Ljus är en sorts elektromagnetisk strålning. Förklara kort vad som
händer i atomen då den träffas av ljus.
- Här följer värden på elektronegativiteten för några grundämnen:
Ca 1,0 H 2,1 N 3,0 P 2,1 O 3,5 I 2,5 F 4,0
Ange i vilka föreningar man kan vänta sig jonbindning, polär kovalent bindning eller ren kovalent bindning.
a) P4 b) CaO c) NH3 d) CaF2
- Ange vilken typ av bindning som verkar mellan molekylerna i de fasta
tillståndet i följande fall:
a) CH4 b) NH3 c) H2O d) HI
- Vilka molekyler i uppgift 5 är dipoler. Motivera!
- Ange vilka joner följande jonföreningar delas upp i då
de löses i vatten:
a) KCl
b) CuSO4
c) FeCl3
d) Al(NO3)3
- *Avståndet mellan en natriumjon och en kloridjon i en
koksaltkristall är 0,281 nm. Hur stort är det kortaste avståndet
mellan två joner med samma laddning i en sådan kristall?
Tips! Ta figuren 4.4 a på sidan 42 i läroboken till hjälp.
- *I en tabell kan man utläsa kokpunkterna för följande
ämnen,
H2O: +100 °C H2S: – 62 °C CO2: –78,5 °C
Ge en utförlig förklaring till varför vatten, trots sin låga molekylvikt, har en mycket högre kokpunkt än övriga.
Försök även förklara de övrigas inbördes skillnad så noga som möjligt.
- Skriv på separata papper laborationsrapporter till Hemlaboration
1 och 2. Se ”Mall för laborationsrapport”!
Lycka till!
2004 Nationellt centrum för flexibelt lärande