I en oladdad molekyl är det sammanlagda antalet elektroner i bindningar,
fria elektronpar och udda elektroner lika med summan av atomernas valenselektroner. |
Exempel 1 |
| D |
Punkterna är väteatomernas valenselektroner och H . är elektronstrukturformeln för en väteatom. |
Drag väteatomernas elektroner till kolatomen så att kolatomens elektronstruktur
stämmer med oktettregeln. Drag sedan resten av väteatomerna till kolatomen
så att oktettregeln uppfylls även för väteatomerna. |
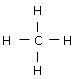
I fortsättningen kommer elektronpar att anges med små streck. Metanmolekylen skrivs då: |
 |
Exempel 2 |
Kolatomen har här tre ”egna” elektroner men eftersom kol har fyra valenselektroner har kolatomen i detta fall laddningen +1. Oktettregeln är inte uppfylld eftersom kolatomen endast omges av 6 elektroner. Karbokatjonen reagerar därför lätt, särskilt med andra laddade partiklar. En reaktion leder till att elektronerna i produkten fördelas efter oktettregelns principer. |
Öva på att bokföra elektroner |
| Elektronfördelningar runt atomer. Rad 2 i
tabellen visar den reaktiva kolatomen i en karbokatjon. De övriga två atomerna är inte reaktiva. |
Uppgift 1. |
Uppgift 2. |
A |
en oladdad bromatom bunden till en annan atom i en molekyl. (Vi tänker oss att bromatomen sitter längst till höger.) |
B |
en bromidjon (en fri brom-anjon) som uppfyller oktettregeln. |
| C | en bromatom med envärt positiv laddning bunden till två kolatomer; de tre atomerna ingår i en cyklisk molekyl. (Vi antar att en av kolatomerna är placerad under bromatomen och en är placerad till höger om den.) |
| D | en envärt positivt laddad bromjon (en fri brom-katjon). (Vi tänker oss att plusladdningen finns på jonens högra sida.) |