Jämvikt mellan kommunicerande kärl
Man kan betrakta en kemisk jämvikt som balansen mellan vätskeytorna i två kommunicerande kärl. Att starta en kemisk reaktion kan liknas med att hälla vatten i det ena kärlet. Så småningom ställer jämvikt in sig mellan vätskeytorna. Tillför man något på ena sidan stiger nivån även på den andra sidan. Detta kan jämföras med den kemiska reaktionen A |
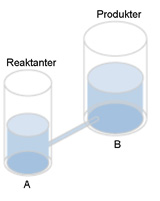
I det här fallet är volymen i kärl B mycket större än A. Förhållandet mellan volymerna B/A blir större än ett. Det motsvarar att koncentrationen av produkten B är mycket större än koncentrationen av reaktanten A, efter reaktionen, när reaktionen nått jämvikt. |
 |
|
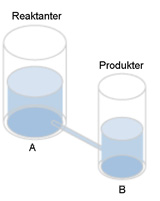
I det här fallet är kärl A mycket större än kärl B. Förhållande B/A får ett siffervärde som är mindre än ett.
|
 |
|
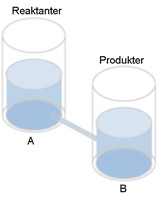
I ett tredje fall kan tunnorna tänkas vara ungefär lika stora. Det har en kemisk motsvarighet i att jämviktskonstanten. K ≈ 1 |
 |
|
| I analogin med kommunicerande kärl kan man illustrera en snabb reaktion med en grov slang. Nu går det snabbt för vätskeytan att ställa in sig i jämviktsläget. | 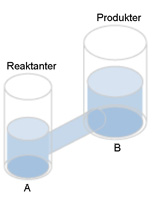 |
|
| Andra jämvikter tar lång tid att ställa in sig. Det motsvaras av en tunn slang mellan kärlen. |  |
Vätskeytorna ställer sig på samma nivå oberoende av om slangen är tunn eller grov. Jämviktsläget är oförändrat. Det är bara tiden det tar till jämvikt som beror på slangens grovlek. Inom kemin anger man reaktionshastigheter med hjälp av s.k. hastighetskonstanter.
Har då vatten slutat rinna mellan kärlen när vätskeytorna står stilla?Man kan lätt visa att så inte är fallet genom att hälla lite färg i det ena kärlet. Efter ett tag är innehållet färgat även i det andra kärlet, trots att vätskenivån är oförändrad. Vätska rinner alltså mellan behållarna, trots en oförändrad vätskenivå, men lika mycket rinner båda riktningarna.
 |
 |