Prov i kemi kurs A
Hjälpmedel: räknedosa + tabellsamlingLösningar och svar skall ges på särskilt inskrivningspapper för de uppgifter som är skrivna med kursiv stil. I övriga fall ges svaret och lösningen i frågehäftet.
Atomens byggnad och periodiska systemet 2(7)
- Vad menas med att ett ämne
a) kondenserar
b) sublimerar
(2)
- Atommassan för Na är 23 u, kärnladdningstalet är
11. Av naturligt natrium finns endast en isotop. Hur många neutroner
finns i en natriumatoms kärna?
(1)
- Ange elektronfördelningen i de olika skalen för
a) Mg
b) Mn
(2)
- Använd periodiska systemet för att få fram några
egenskaper hos grundämnet Se
(2)
- a) Skriv formeln för det salt som består av jonerna Fe3+
och SO42-
b) Avgör t ex med hjälp av periodiska systemet, vilken av följande formel som är felaktig
Cs2S RaCl2 Ga2O3 Ba5N2 RbFr
(2)
- Nedan anges för några ämnen om de leder elektrisk
ström eller inte.
Två påståenden är felaktiga. Vilka?
1) Flytande tetraklormetan, CCl4 leder inte elektrisk ström
2) Smält kalciumklorid, CaCl2 , leder elektrisk ström
3) Flytande argon, Ar, leder inte elektrisk ström
4) Fast argon leder elektrisk ström
5) Fast kvicksilver, Hg, leder elektrisk ström
6) Fast natriumklorid, NaCl, leder elektrisk ström.
(2)
- Skriv elektronformeln för
a) NH3 b) S2Cl2
(2)
- Rita strukturformler för tre isomerer av kolvätet C4H8.
Alla atomerna skall sättas ut i formlerna.
(2)
Reaktionsformler och beräkningar 3(9)
Till uppgifterna 10 – 12 krävs fullständiga lösningar på särskilt inskrivningspapper
- Skriv reaktionsformeln för då ett stearinljus brinner. Vid förbränningen
bildas koldioxid och vatten. Stearin har formeln C17H35COOH.
(2)
- Man vill framställa 0,50 dm3 natriumkloridlösning
med koncentrationen 0,25 mol/dm3. Hur stor massa natriumklorid
skall man väga upp ?
(2)
- En aluminiumsulfat lösnings bereds påföljande sätt:
12,74 g av saltet vägs upp och överförs till en mätkolv
med volymen 250 cm3. Kolven fylls till hälften med vatten.
Efter att saltet lösts fullständigt fylls kolven till märket.
Lösningen hälls sedan över på en flaska.
a) Ange vad som skall stå på flaskans etikett.
b) Hur stor är [Al3+] i lösningen?
(3)
- En legering av koppar och aluminium behandlas med saltsyra. Därvid
sker reaktionen
2 Al(s) + 6 HCl(aq) 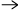
3 H2(g) + 2 AlCl3(aq)
0,350 g av legeringen ger 415 cm3 vätgas vid 25 °C och 101 kPa. Beräkna massprocenten aluminium i legeringen. Molvolymen är 24,5 dm3/mol vid detta tryck och temperatur.
(2)
Syror och baser 2(8)
- Skriv protolysreaktionerna för kolsyra H2CO3
i vatten
(2)
- Ordna följande lösningar efter ökande pH. Lösningen
med lägst pH anges alltså först.
a) En lösning med pH = 2,80
b) En 0,002 mol/dm3 HCl lösning
c) En lösning med [H3O+] = 3,2·10-2 mol/dm3
(1)
- I en saltsyralösning är pH = 3,0. Man späder 1,0 cm3
av lösningen med vatten till 100 cm3.
a) Vad blir pH i den utspädda lösningen?
1) 0,030
2) 1,0
3) 3,0
4) 4,0
5) 5,0
(1)
- Vilka två av följande påståenden
är korrekta?
Vid alla syra-basreaktioner
a) sker en protonöverföring
b) bildas vatten
c) bildas en syra och en bas
d) bildas ett salt
e) blir lösningen neutral
(1)
- En 0,15 mol/dm3 salpetersyralösning med volymen 25
cm3 neutraliseras med 0,100 mol/dm3 NaOH.
a) Skriv reaktionsformeln för neutralisationen
b) Beräkna hur mycket NaOH-lösning som går åt.
Fullständig lösning krävs
(3)
Oxidation-reduktion, energi och elektrokemi 2(8)
- Vilka ämnen har reducerats i följande reaktioner?
a) Fe2O3 + 3CO 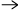
2Fe + 3CO2 b) 2Ag+ + Cu(s) 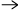
Cu2+ + 2Ag(s)
(2)
- Fullborda följande reaktionsformel. Minsta möjliga heltalskoefficienter
skall anges.
...... S2- + ...... I2 + ....... OH- 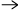
..... SO42- + ...... I- + ..... H2O
(2)
- Motivera med hjälp av användning av spänningsserien
vilka två av följande reaktioner som sker spontant.
a) Zn2+(aq) + Cu(s) 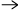
Zn(s) + Cu2+ b) Cu(s) + 2 Ag+(aq) 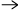
Cu2+(aq) + 2 Ag(s) c) 2 Ag(s) + Zn2+(aq) 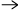
2 Ag+(aq) + Zn(s) d) Fe(s) + Zn2+(aq) 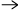
Fe2+(aq) + Zn(s) e) Cl2(aq) + 2 I- 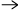
2 Cl-(aq) + I2(aq)
(1)
- Vilka elektrodreaktioner sker vid elektrolys av utspädd aluminiumsulfatlösning?
(1)
- Ett skruvförband som består av en plåt av ett material
och en bult av ett annat material sätts ned i en syrgasmättas
vattenlösning. Efter någon tid visar plåten enjämn
avfrätning medan bulten inte har angripits .
a) Vilket av nedanstående påståenden är felaktigt? - Bulten är av ädlare material än plåten
- Vattenlösningens konduktivitet är utan betydelse för korrosionsförloppet.
- Plåten har oxiderats
- På bulten har syrgas reducerats
b) Ge ett förslag på vilka material bulten respektive plåten kan bestå av. (2)
2004 Nationellt centrum för flexibelt lärande