I formeln nedan anges oxidationstalen för de olika ämnena
| 0 | +II | +II | 0 | |||
| Zn | + | Cu2+ | Zn2+ | + | Cu |
Av formeln framgår att zink har ökat sitt oxidationstal
då det avgav 2 elektroner till koppar medan kopparen minskat
sitt oxidationstal då den tog upp två elektroner vid reaktion.
Vid oxidation avges elektroner och vid reduktion tas elektroner upp.
I detta fall har zink oxiderats eftersom det har avgivit elektroner och
kopparn reducerats ty den har upptagit elektroner.
Man kan även definiera oxidation med hjälp av oxidationstalsändring
och får då följande :
oxidation = ökning av oxidationstal
reduktion = minskning av oxidationstal
Här nedan följer några övningar på oxidationstalsändringar:
- Vilka av följande processer innebär en oxidation?
a) NO 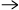
NO2 b) NH3 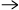
N2 c) N2O3 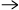
N2O5 d) NH3 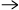
NH4+
- Vilka av följande reaktioner är redoxreaktioner?
a) N2 + 2O2 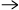
2NO2 b) 2NO2 + H2O 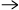
HNO2 + HNO3 c) N2O5 + H2O 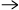
2 HNO3
- Vilket atomslag i vänstra ledet har oxiderats och vilket har
reducerats i följande redoxreaktioner?
a) 2 Mg + CO2 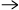
2 MgO + C b) CH4 + O2 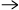
CO2+ 2H2O c) FeS + 2O2 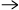
FeSO4 d) 3Cu + 2NO3- + 8H+ 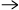
3Cu2+ + 2NO + 4H2O e) 5Fe2+ + MnO4- + 8H+ 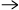
Mn2+ + 5Fe3+ + 4H2O
Svar till dessa övningar finns HÄR